近日,ky开云手机版林金星与荆艳萍团队合作在Plant Communications(一区Top,IF:10.5)上发表了题为“The VAMP-associated protein VAP27-1 plays a crucial role in plant resistance to ER stress by modulating ER-PM contact architecture in Arabidopsis”的研究论文。

真核细胞中,不同膜性细胞器之间的相互作用和频繁的物质与信息交换,对维持细胞内环境的稳态至关重要。因此,细胞器相互作用和膜接触位点ky开云手机版的解析是探究细胞多种多样生理活动的重要切入点。内质网与细胞质膜之间存在接触位点,即内质网-质膜连接点 (ER–PM contact site, EPCS)。当逆境胁迫导致蛋白质的折叠过程受损时,引发内质网胁迫,细胞将启动未折叠蛋白反应 (unfolded protein response, UPR) 来抵御内质网胁迫。皮层内质网及 ER-PM 结合位点参与了细胞对内质网胁迫的响应。满奕等研究了定位于ER–PM连接点的拟南芥囊泡关联膜蛋白相关蛋白VESICLE-ASSOCIATED MEMBRANE PROTEIN (VAMP)-ASSOCIATED PROTEIN 27-1 (VAP27-1) 参与内质网胁迫的生物学功能。
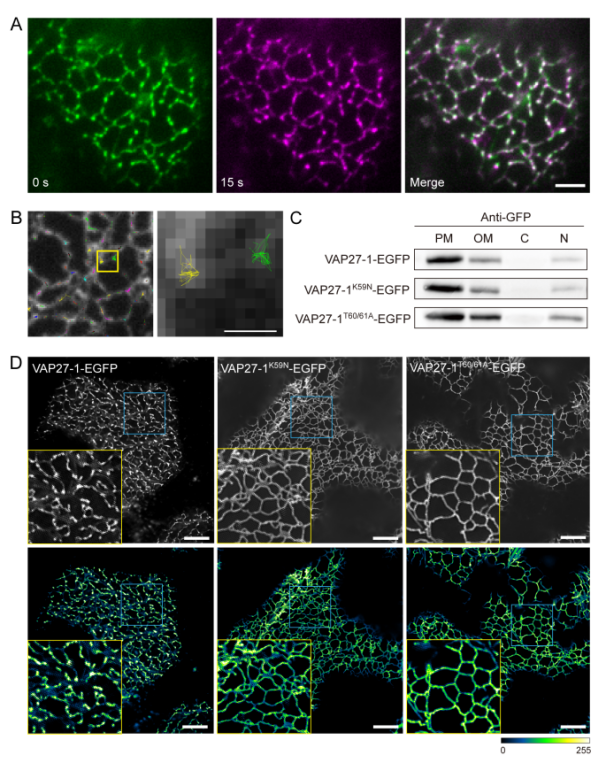
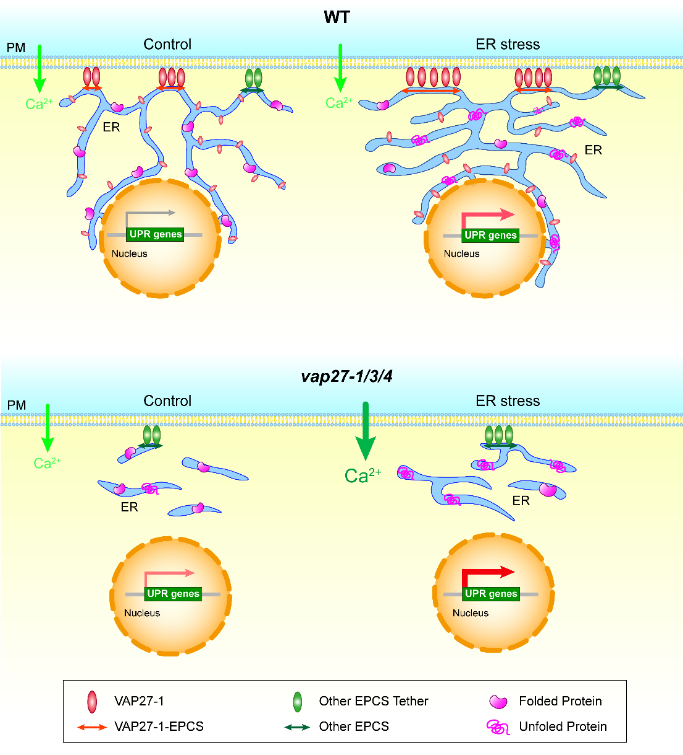
该研究突破了传统成像技术的局限,采用先进的可变角度全内反射荧光显微镜 (VA-TIRFM),结合单颗粒示踪技术 (SPT),并联合运用超分辨结构光照明显微术 (SIM),在植物活体细胞中实时捕获了超高时空分辨率的内质网-质膜互作ky开云手机版,揭示了VAP27-1在细胞质膜的分子重排和ky开云手机版变化,以及维持ER-PM结构的关键作用。进而,利用CRISPR/Cas9技术创制的vap27-1/3/4突变体研究发现,内质网胁迫后,突变体拟南芥根长受到显著抑制,并且表现出更强的UPR信号。此外,长时间内质网胁迫处理导致vap27-1/3/4突变体的中Ca2+水平显著上升。因此,UPR途径作为长时间内质网胁迫所引发的下游信号途径,需要胞内钙稳态的平衡。作者的研究结果深化了植物内质网胁迫及未折叠蛋白反应信号途径的分子及细胞学机制,揭示了胞内Ca2+稳态在细胞器应激中的重要作用,为提高植物广谱性抗逆提供了新思路。
ky开云手机版已出站博士后满奕和在站博士后张越为论文的共同第一作者,北京林业大学荆艳萍教授和林金星教授为共同通讯作者。北京林业大学硕士生陈玲慧,博士生周骏辉、博士后卜芋芬,北京林业大学李晓娟教授、李云教授与青年教师张曦博士也参与了该研究工作。该研究得到了国家自然科学基金 (32170689, 91954202, 32030010)、国家重点研发计划课题(2022YFF0712500 )、国家高等学校学科创新引智计划 (111项目,B13007) 和北京林业大学优秀研究生导师团队项目(YJSY-DSTD2022005)的支持。
原文链接:https://www.cell.com/plant-communications/fulltext/S2590-3462(24)00199-8
作者:林金星、荆艳萍教授团队
审核:杜庆章

